Rougeole
Si la vaccination a considérablement réduit le nombre de décès dans le monde avec une baisse de 73 % entre 2000 et 2018, on déplore encore chaque année entre 150 000 et 200 000 décès, principalement des enfants de moins de 5 ans vivant en Afrique subsaharienne. En outre l’OMS a recensé une augmentation de 79 % des cas à travers le monde au cours des deux premiers mois de l’année 2022 par rapport à la même période en 2021. Le rebond amorcé en 2016 semble donc se confirmer, voire s’accentuer, et rappelle le besoin de poursuivre la lutte contre cette maladie infectieuse.
La rougeole est une infection virale qui touche principalement les enfants. C’est une maladie très contagieuse puisqu’on estime qu’une personne peut en contaminer entre 15 et 20. Elle donne lieu à de forte fièvre, de la toux, une rhinopharyngite, puis des éruptions cutanées. Les premiers symptômes se confondent avec ceux d’autres pathologies, et le malade est contagieux avant l’apparition des éruptions cutanées, signes caractéristiques de la rougeole, et jusqu’à 5 jours après, ce qui facilite sa propagation.
La rougeole : Une maladie sans traitement spécifique
Il n’existe aucun traitement spécifique contre la rougeole ; la prise en charge consiste à traiter les symptômes. Des complications sévères surviennent dans environ 30 % des cas, principalement chez les enfants de moins de 5 ans, malnutris ou soufrant de déficiences immunologiques comme le VIH à un stade avancé. La complication la plus sévère est souvent une pneumonie. Dans les contextes où la mortalité infantile est supérieure à 100 pour 1000 enfants, le taux de létalité de la rougeole peut dépasser 5 % (1). De plus, le virus détruit certaines cellules du système immunitaire pendant les premiers jours de l’infection, rendant la personne infectée sensible à d’autres infections opportunistes.
Une couverture vaccinale encore largement insuffisante
Depuis les années 60, on dispose d’un vaccin efficace pour prévenir la maladie. Son introduction a permis de réduire l’impact de la rougeole et la mortalité induite. Toutefois pour éradiquer la maladie, il faut que 95 % de la population soit immunisée, une couverture vaccinale loin d’être atteinte dans de nombreux pays.
Deux doses de vaccins sont nécessaires pour garantir un niveau élevé d’immunité. Une première injection est administrée aux nourrissons entre 9 mois et 11 mois. Dans de nombreux pays, la deuxième dose n’est que rarement administrée. Une publication parue en 2021 (2) met en évidence une amélioration de la couverture par la première dose de vaccin dans 15 pays d’Afrique (Bénin, Burkina Faso, Cap-Vert, Côte d’Ivoire, Gambie, Ghana, Guinée, Guinée Bissau, Libéria, Mali, Niger, Nigéria, Sénégal, Sierra Leone et Togo) : elle passe de 45 % en 2001 à 66 % en 2019. En revanche seuls 7 pays sur les 15 ont introduit la deuxième dose de vaccin et aucune réintroduction n'a eu lieu depuis 2015. En se basant sur plusieurs paramètres, les auteurs de cette étude estiment que 12 des 15 pays ne remplissent pas les critères pour espérer atteindre les objectifs d'élimination de la rougeole. Ce constat est à pondérer puisqu’ils notent également que des pays comme le Cap-Vert, la Gambie et le Ghana ont fait des progrès substantiels.
Rougeole : une maladie en recrudescence
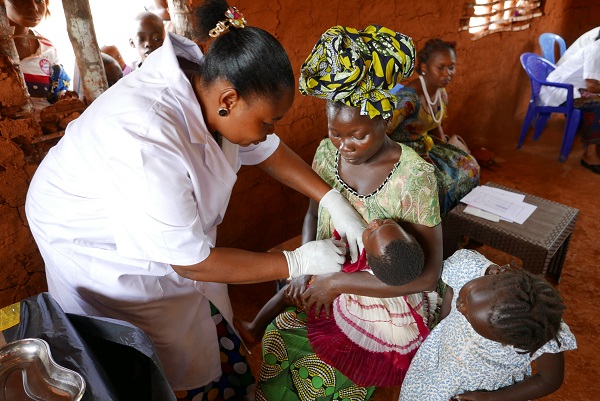
La rougeole sévit dans de nombreux pays dans le monde. Elle touche principalement les régions en proie à des conflits et à l’instabilité avec d’importants déplacements de populations, où les campagnes vaccinales sont interrompues. En outre, une quarantaine de pays ont reporté leurs campagnes de vaccination contre la rougeole pour 2020 ou 2021 en raison de la pandémie de COVID-19 (4). Selon l’OMS en 2020, plus de 22 millions de nourrissons n’ont pas reçu leur première dose de vaccin contre la rougeole, soit trois millions de plus qu’en 2019 (3). Entre avril 2021 et avril 2022, 21 flambées épidémiques majeures de rougeole ont été recensées. Depuis le début 2022, de nombreux cas ont été reportés au Nigéria, en Inde, au Libéria, en Ethiopie, au Pakistan, en Afghanistan, en RDC, Somalie, Somaliland, Zimbabwe, Tchad, Yémen…
MSF est impliqué dans la riposte au Nigeria, au Tchad, en Guinée, au Soudan du Sud, au Somaliland, en Afghanistan, au Yemen.
Rougeole, MSF, Epicentre : une longue pratique
Guerre, instabilité et déplacement de population créent les conditions idéales à la survenue de flambées épidémiques de rougeole. MSF a une longue pratique de prise en charge et de vaccination contre cette maladie infectieuse dans de nombreux contextes. Parallèlement Epicentre décrit les épidémies survenant dans ces différents contextes, évalue la couverture vaccinale, la mortalité, les liens avec la situation nutritionnelle et ou encore l’utilisation du vaccin en dehors de la chaîne de froid.
La rougeole : un fardeau sous-estimé
Depuis 2008, Epicentre tente d’évaluer le fardeau réel de la rougeole et d’identifier les personnes les plus vulnérables face à cette maladie. Car si la mortalité par suite de la rougeole est faible dans les pays industrialisés, elle reste très certainement sous-évaluée dans d’autres contextes. Le décès survient souvent 1 mois après l’infection et il est fréquemment provoqué par une pneumonie, donc rarement attribué à la rougeole.
Une enquête (5) consécutive à une importante épidémie de rougeole survenue en 2013 dans la zone de santé d'Aketi en République démocratique du Congo (RDC) a mis en évidence :
- Un taux d'attaque de 14 % (35 % chez les enfants de moins de 5 ans) durant l’épidémie,
- Un taux de létalité de 4,2 % (6,1 % chez les enfants de moins de 5 ans).
Par ailleurs, les enfants les plus jeunes, ceux qui n'ont pas reçu de soins et ceux qui vivaient loin de l'hôpital d’Aketi au début de l'épidémie avaient un risque plus élevé de décéder de la rougeole. A noter que la couverture vaccinale avant l'épidémie était seulement de 76 % et qu’une campagne de vaccination réactive a eu lieu, mais tardivement, ce qui explique très certainement ce taux d'attaque élevé.
Pourtant la RDC a mis en place une stratégie nationale de lutte contre la rougeole qui repose sur le Programme élargi de vaccination (PEV) pour la vaccination de routine, les activités de vaccination supplémentaire (AVS) et la vaccination en riposte aux épidémies (RRI). Mais la mise en place de ces stratégies vaccinales, leur timing, leur couverture géographique, les tranches d’âge à considérer, leur enchaînement… posent encore de nombreuses questions.
Optimiser les stratégies vaccinales
De l’intérêt de vacciner en phase épidémique
En 2008, une étude d’Epicentre (6) a montré l’intérêt de la vaccination en phase épidémique au Niger, un sujet jusqu’alors controversé. Cette étude a aussi mis en évidence que l'augmentation de la couverture vaccinale et la vaccination en phase épidémique allonge l’intervalle entre deux grandes épidémies. En outre une réponse plus précoce avec une couverture plus faible (~60%) semble plus efficace qu'une réponse plus tardive avec une couverture plus élevée (>90%). La vaccination de riposte sera d’autant plus efficace que le système d’alerte et de surveillance permet de détecter l’apparition des premiers signes d’épidémie le plus tôt possible, ce qui est rarement le cas.
De la complexité de détecter les risques épidémiques
Pour qu’une riposte soit mise en place, il faut d’abord définir un seuil d’alerte et que celui soit dépassé au niveau d’une zone géographique. Toute la difficulté réside dans la détermination d’un seuil d’alerte suffisamment sensible pour ne pas rater d’épidémie et assez spécifique pour ne pas déclencher de fausses alertes.
A partir des analyses des épidémies de 2018-2020 en RDC, Epicentre avait proposé un seuil d’alerte à deux options, soit la détection de 20 cas suspects par semaine dans une zone de santé, soit 35 cas suspects sur 3 semaines. Au vu de l’expérience et de l’existence de zones à risque élevé d'épidémies, il a semblé plus pertinent d’avoir plus d'alertes et plus tôt, même si cela génère un risque plus élevé de fausses alertes.
Ce constat a conduit à intégrer la notion de zones à plus haut risque épidémique dans le projet Urgepi déployé dans les régions du Haut-Lomami, Haut-Katanga, Tanganyika et Lualaba (ex Katanga) et qui comporte 4 types d’activité :
- La surveillance de toute la zone, avec toutefois une prise en compte des zones sanitaires à haut risque avec notamment une détection des alertes plus précoces et une collecte de données plus détaillées
- La mise en œuvre d’une riposte en cas d’alerte avec de kits rougeole, une formation régulière du personnel de santé dans les centres, et des équipes d’intervention rapide en cas de confirmation d’une épidémie.
- La prévention avec des campagnes de vaccination de rattrapage dans les zones à haut risque
- L’ouverture d’un laboratoire à Lubumbashi pour réduire le délai de confirmation du diagnostic. Car la confirmation du diagnostic biologique de la rougeole nécessite d’avoir recours à des tests Elisa. Or jusqu’à récemment seul un laboratoire à Kinshasa pouvait les effectuer, ce qui impliquait plusieurs jours, voire semaines de transport pour les échantillons.

Au vu des premières expériences, si la détection précoce avec le seuil sensible dans les zones à risques a permis d’intervenir avant que l’épidémie ne progresse de manière substantielle, ce n’est pas toujours le cas. Il serait donc intéressant de voir si l’intégration des tests rapides de diagnostic en cours de développement pourrait permettre une détection plus fiable et plus précoce des cas et donc de l’intervention.
Mieux cibler la vaccination …
Dans les pays à haut risque de rougeole, des activités de vaccination supplémentaires (AVS) sont organisées périodiquement pour atteindre les enfants qui n'auraient pas bénéficier de la 1ère dose ou ceux qui n’auraient pas développé d’immunité lors de la 1ère injection, ce qui est le cas pour 20 % des enfants. Fréquemment, ces AVS font office de 2e dose pour une partie des enfants.
Prioriser la vaccination passe par l’identification de zones où demeurent un grand nombre d’enfants non immunisés, soit car ils n’ont pas été vaccinés, soit parce qu’ils n’ont pas été exposé au virus. Une étude menée par Epicentre en RDC montre qu’une combinaison d’indicateurs de type couverture vaccinale, temps depuis la dernière épidémie et proximité d’autres foyers épidémiques potentiels pourrait orienter ce choix.
… grâce à des enquêtes de séroprévalence
Les enquêtes de séroprévalence peuvent aussi servir à guider les stratégies vaccinales. Quantifier les anticorps présents, qu’ils résultent d’une exposition à la rougeole ou de la vaccination, permet d’évaluer la protection face à la rougeole. Ainsi une enquête menée par Epicentre dans quatre zones de santé de l'ancienne province du Katanga – désormais Haut-Lomami, Haut-Katanga, Tanganyika et Lualaba - après l'épidémie de 2015 a mis en avant une seroprevalence de 85% chez les enfants âgés de 5 ans à 14 ans, avec de fortes variations chez les moins de 5 ans en fonction de la zone (7). Ces enquêtes révèlent la faible couverture vaccinale du PEV dans certaines zones, ce qui pourrait être la cause de l’épidémie de 2015. Les deux zones, avec une faible séroprévalence chez les enfants de moins de 5 ans, ont été le siège de nouvelle épidémie en février 2016 et janvier 2017.
Les enquêtes sérologiques fournissent des informations supplémentaires pour guider les prises de décision quant à la nécessité et le moment pour mettre en place des AVS. En février 2020, Epicentre a réévalué l’immunité face à la rougeole dans la région du haut Katanga. Des résultats préliminaires et, donc à confirmer, font état d’une seroprevalence chez les enfants 6 mois à 15 ans de 59 % sans différence en fonction de l’âge. 81% avaient reçu une dose dans le cadre du PEV et/ou de l’AVS de 2019 et ce pourcentage atteint 86% chez les moins de 5 ans. Malgré les AVS, la couverture vaccinale reste trop faible et la séroprévalence est plus basse que prévue chez les 5-15 ans à priori pourtant exposés à de multiples épidémies.
De ces enquêtes ressort l’importance des AVS et des campagnes réactives lorsque que la couverture vaccinale est faible, mais aussi que le délai de 3 ans entre deux AVS est très certainement trop long. Cet intervalle devrait être adaptée en fonction du taux de natalité et de la couverture vaccinale si l’on veut atteindre le seuil de 95 % de vaccination et donc propre à chaque contexte.
Dans la même idée, une analyse comparative de la situation au Malawi et en RDC par MSF et Epicentre (8) met en lumière le besoin d’adapter la riposte lors d’une flambée de rougeole à l'épidémiologie locale, en insistant sur le fait que la répartition par âge des premiers cas doit guider la décision sur les groupes d'âge à vacciner en priorité. Alors que les campagnes de vaccination de masse non ciblées sont généralement la norme face à une épidémie, la vaccination des plus jeunes enfants plus susceptibles de développer des formes graves et de mourir devrait peut-être être privilégiée.
Un vaccin qui date des années 60
Se pose aussi la question du vaccin et de sa conservation. En effet les épidémies de rougeole surviennent le plus souvent dans des régions éloignées, parfois soumises à l'insécurité, donc difficile d’accès pour des vaccins qui se conservent entre 2 et 8 °C. Epicentre a montré que le vaccin dans sa forme lyophyslisée monodose peut se conserver jusqu'à 6 jours à 37°C ou 2 jours à 40°C (9). Il s’agit désormais d’établir si cela représente un avantage opérationnel.
D’autres se penchent sur le développement d’un vaccin sous forme de patch plus facilement administrable.
En résumé
La vaccination reste bien en dessous des seuils nécessaires pour éradiquer la rougeole dans de nombreux pays et notamment en RDC, l’un des plus touchés par cette maladie. Limiter les risques épidémiques passe par l'amélioration de la couverture du PEV, du ciblage de la vaccination, du délai de riposte, de la couverture des AVS, mais aussi par la mise en place des seuils d’alerte adaptés aux contextes.
La lutte contre la rougeole progresse dans toute l'Afrique subsaharienne, mais on voit depuis quelques années et avec une accélération depuis début de l’année 2022 une recrudescence qui montre combien ces avancées sont fragiles. Chaque pays doit se fixer ses propres priorités en matière de réponse aux flambées et de stratégies vaccinales en fonction de l'épidémiologie locale. Il n’existe pas une solution unique pour tous, mais des solutions adaptées à chaque contexte.
crédit photo : Moses Sawasawa/Epicentre, Caroline Thirion/MSF, Juliette Muller/MSF
(1) Portnoy A Jit M Ferrari M Hanson M Brenzel L Verguet S. Estimates of case-fatality ratios of measles in low-income and middle-income countries: a systematic review and modelling analysis. Lancet Glob Health. 2019; 7: e472-e481
(2) Wariri O Nkereuwem E Erondy NA et al. A scorecard of progress towards measles elimination in 15 west African countries, 2001–19: a retrospective, multicountry analysis of national immunisation coverage and surveillance data. Lancet Glob Health. 2021; 9: e280-e290
(4) https://www.cdc.gov/globalhealth/measles/data/global-measles-outbreaks.html
(5) Gignoux E, Polonsky J, Ciglenecki I, Bichet M, Coldiron M, Thuambe Lwiyo E, Akonda I, Serafini M, Porten K. Risk factors for measles mortality and the importance of decentralized case management during an unusually large measles epidemic in eastern Democratic Republic of Congo in 2013. PLoS One. 2018 Mar 14;13(3):e0194276. doi: 10.1371/journal.pone.0194276. eCollection 2018.
(6) Ferrari MJ, Grais RF, Bharti N, Conlan AJ, Bjørnstad ON, Wolfson LJ, Guerin PJ, Djibo A, Grenfell BT. The dynamics of measles in sub-Saharan Africa. Nature. 2008 Feb 7;451(7179):679-84. doi: 10.1038/nature06509.
(7) Keating P, Carrion Martin AI. Blake A, Lechevalier P, Uzzeni F, Gignoux E, Okonta C, Langendorf C, Smit C, Ahuka C, Suchard M, Pukuta E, Degail ME, Hansen L, Kibanza-Kyungu J, Ciglenecki I, Cohuet S. Measles seroprevalence after reactive vaccination campaigns during the 2015 measles outbreak in four health zones of the former Katanga Province, Democratic Republic of Congo. BMC Public Health 2019 Aug 22;19(1):1153. doi: 10.1186/s12889-019-7500-z.
(8) Measles outbreak response immunization is context-specific: insight from the recent experience of Médecins Sans Frontières. Minetti A, Bopp C, Fermon F, François G, Grais RF, Grout L, Hurtado N, Luquero FJ, Porten K, Sury L, Terzian M.PLoS Med. 2013 Nov;10(11):e1001544. doi: 10.1371/journal.pmed.1001544. Epub 2013 Nov 5.PMID: 24223523
(9) Evaluation of the stability of measles vaccine out of the cold chain under extended controlled temperature conditions. Juan-Giner A, Alsalhani A, Panunzi I, Lambert V, Van Herp M, Gairola S. Vaccine. 2020 Mar 4;38(11):2473-2477. doi: 10.1016/j.vaccine.2020.02.005.